

来源:靶点社 发布时间:2022-07-26
癌细胞与正常细胞的不同就在于其通过激活端粒维持机制(TMM)来延长端粒,实现复制永生。人体内除了部分干细胞群,正常的体细胞缺乏端粒维持机制,这意味着癌细胞的端粒维持机制具有高度特异性,是非常有吸引力的药物开发靶点。
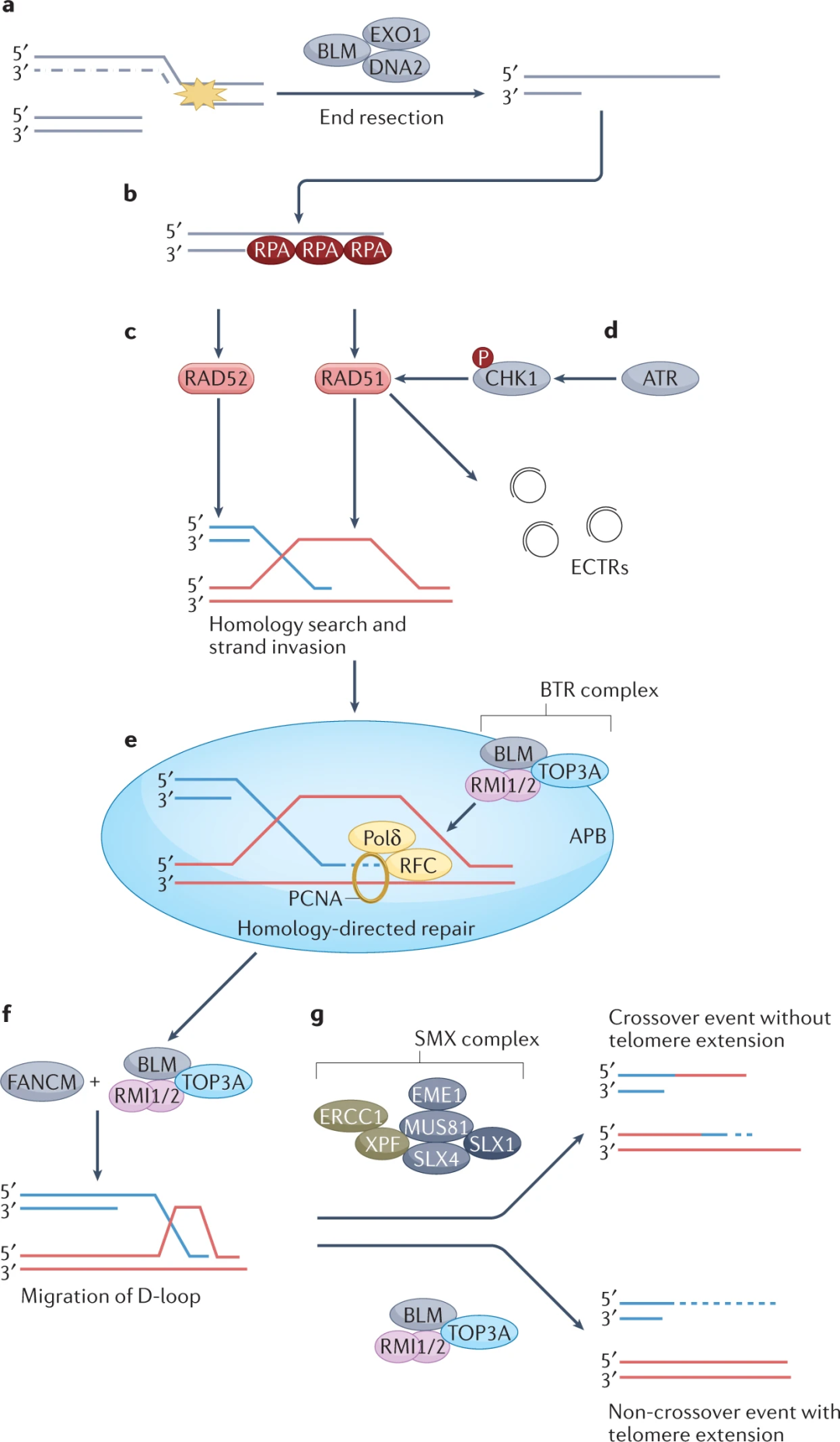
端粒维持机制主要有两种,一种是依赖于核糖核蛋白端粒酶机制,一种涉及同源定向修复(HDR)途径,称为端粒替代延长(ALT)。
端粒酶介导的端粒延长
端粒酶的活性由端粒酶逆转录酶(hTERT)催化,其将端粒重复序列直接逆转录到染色体末端,并且需要hTR (一种嵌入了固有端粒模板区域的RNA分子)的辅助。当端粒单链突出端与hTR 23中的互补RNA模板(5'-CUAACCCUAAC-3')结合时,端粒重复延伸开始,然后端粒酶活性位点沿着模板移动,直到它到达5'边界,此时端粒酶沿着DNA产物解离或易位。
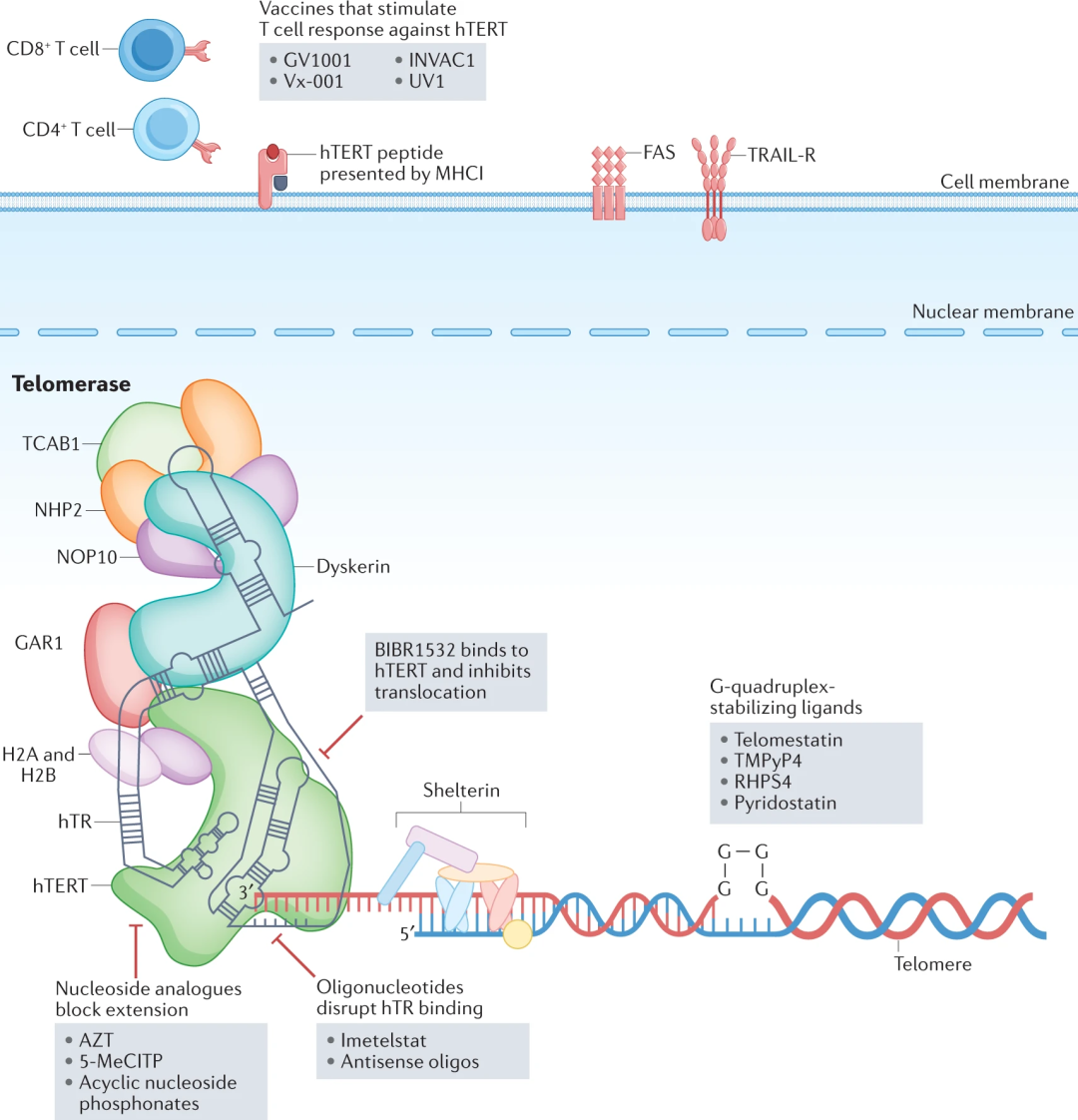
在分化的体细胞中,hTERT的表达受到抑制,而癌细胞使用多种方法重新表达hTERT,从而重新激活端粒酶。
端粒的替代延长
端粒的替代延长是一种不依赖端粒酶的TMM,它依赖HDR来延长端粒。
其活性受到α-地中海贫血/智力迟钝综合征X连锁(ATRX)或死亡域相关蛋白6(DAXX)的缺失会引发的染色质分解,和核小体重塑/组蛋白去乙酰化酶(NuRD)-锌指蛋白827(ZNF827)复合物/组蛋白-赖氨酸N-甲基转移酶SETDB1的染色质压实的调控。
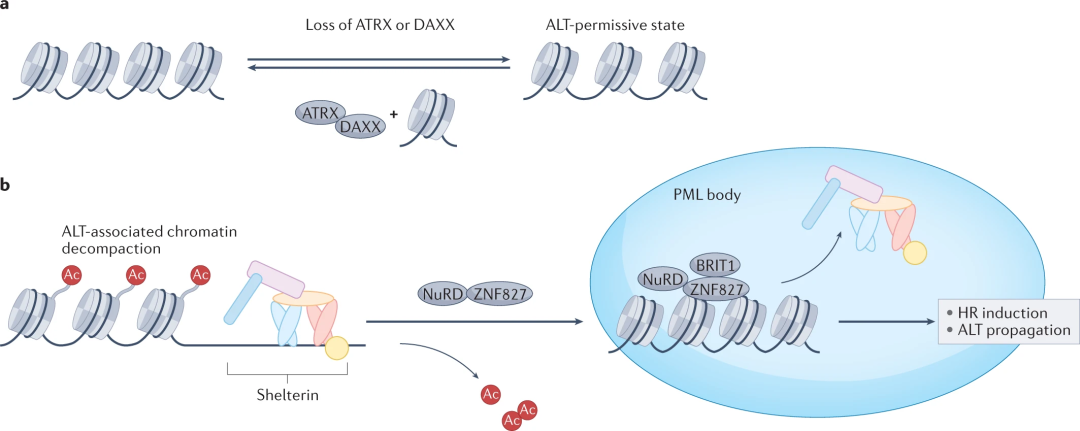
染色质重塑产生ALT允许状态
其可以减轻端粒复制的压力,在端粒处还参与多种DNA修复途径。
ALT通路产生几种生物标志物,异质端粒长度、端粒姐妹染色单体交换、APB(ALT相关早幼粒细胞白血病体)和ECTR(染色体外端粒重复序列)。
靶向端粒酶的药物研发策略
一直以来,学界认为大约85-90%的人类肿瘤表达端粒酶,而剩余的10-15%依赖ALT维持端粒,因此大量的端粒癌症疗法集中在靶向端粒酶上。
最初的思路是直接抑制抑制端粒酶的活性来抑制端粒的延长,但多少会存在一些限制,比如端粒酶抑制之后的滞后阶段(端粒酶缩短到临界长度需要时间,此时肿瘤会按照原计划增殖进展),以及对干细胞的潜在毒性,这些细胞也依靠端粒酶进行再生。
于是衍生出了其他除单独抑制端粒延伸之外发挥作用的端粒酶靶向疗法,比如针对hTR的寡核苷酸,核苷类似物,hTERT小分子抑制剂和针对hTERT的免疫疗法,G4稳定配体等。
针对hTR的寡核苷酸
寡核苷酸可以和互补的DNA形成稳定的双链体,破坏hTR的功能。但天然的寡核苷酸细胞渗透性不强,因此需要增加其亲脂性,来优化其细胞渗透性和生物利用度,一般使用N3'-->P5'氨基磷酸酯或者2'-O-甲基对RNA/DNA反义寡核苷酸进行取代。其与hTR序列模板结合后,可有效抑制端粒重复加成的催化作用,从而抑制端粒酶的活性。
此类的代表药物是imetelstat(GRN163L,geron公司),其核心结构是核酸+脂质(13-merN3'→P5'硫代氨基磷酸酯反义寡核苷酸,与5'-棕榈酰基团偶联)。它在不同的肿瘤模型中显示出体外和体内疗效,是目前唯一进入临床的寡核苷酸。2019年,在II期试验后,imetelstat被FDA快速指定用于复发或难治性骨髓纤维化。
核苷类似物
端粒酶会将核苷类似物共价掺入到端粒末端,由于核苷类似物不存在3'-OH官能团,则端粒延长中的核苷酸添加不能正常进行。
有意思的是许多以前用于抑制人类免疫缺陷病毒(HIV)逆转录酶的类似物也可抑制hTERT催化位点。目前已经有研究的核苷类似物包括叠氮胸苷(AZT;FDA批准用于治疗HIV)、6-硫代-2'-脱氧鸟苷(6-硫代-dG)和5-甲基羧基-吲哚基-2'-脱氧核苷5'-三磷酸(5-MeCITP)。
MeCITP是一种含有甲氧基的吲哚核苷酸类似物,甲氧基仍被困在端粒酶的催化位点,以防止端粒酶进一步延长端粒。
hTERT小分子抑制剂
hTERT小分子抑制剂抑制端粒酶活性主要通过两种方式,一种是与hTERT结合,一种是阻断hTERT基因的转录。
BIBR1532
BIBR1532( 2-[(E)-3-naphthalen-2-yl-but-2-enoylamino]-benzoicacid)是第一种里面的代表性药物,其在非催化位点与hTERT结合,从而以非竞争性动力学抑制端粒酶活性。
BIBR1532不会阻断最初的端粒延伸事件,而是与端粒酶拇指结构域的疏水口袋相互作用,防止进一步的端粒重复添加。其细胞毒性主要来源于对端粒结构的直接损伤引起的,会导致TRF2结合丧失,从而诱导端粒功能障碍的标志物,包括端粒端到端融合和p53激活增加。在临床前研究中,BIBR1532已在多种癌细胞系和异种移植模型中显示出有效的效果,包括乳腺癌、纤维肉瘤、子宫内膜癌和白血病。在临床上,使用BIBR1532使耐药癌细胞增加对化疗敏感,这可能是由其端粒损伤作用引起。
阻断hTERT基因转录
最初通过表没食子儿茶素没食子酸酯(EGCG)来抑制hTERT转录。EGCG可抑制DNA甲基转移酶1(DNMT1),导致hTERT启动子变为低甲基化,从而结合Rb-E2F1-组蛋白去乙酰化酶1(HDAC1)阻遏物并抑制hTERT转录。
由于EGCG相对不稳定,已探索用EGCG相关部分合成的化合物作为改进的hTERT抑制剂,代表性药物就是MST-312。用MST-312治疗各种癌症类型的细胞,包括乳腺癌、肺癌和结肠癌,会导致hTERT表达下调、端粒酶活性降低和端粒缩短,从而导致细胞周期停滞和细胞凋亡。但是由于端粒缩短到临界长度需要时间(90天),MST-312 仅对一些端粒较短的癌细胞起作用,端粒较长的细胞会在滞后期适应端粒酶活性的丧失,在长时间处理时(>200天)恢复到原来的生长速度。
也有其他被筛选出来的药物,比如直接抑制hTERT催化结构域的Nu-1和红霉素抗生素,以及阻断hTERT转录的蟾毒灵和雷帕霉素。但是这些一直处于早期研究,因为效力低且细胞毒性起效慢。
针对hTERT的免疫疗法
癌细胞可以加工内源性hTERT并通过主要组织相容性复合物(MHC)I和II分子在细胞表面呈递hTERT肽,由此可以开发针对表面hTERT的疫苗。hTERT疫苗通常包含酶的肽,其被注射后由树突细胞将抗原呈递给淋巴结中的CD4+ T辅助1(TH 1 )细胞。这些hTERT特异性TH 1细胞迁移到肿瘤中,刺激CD8+ T细胞对表达hTERT的癌细胞的活性,或通过释放细胞因子或与FAS或肿瘤坏死因子相关的凋亡诱导配体(TRAIL)凋亡诱导受体相互作用直接杀死癌细胞。
GV1001
疫苗的先锋是GV1001,虽然可以显著延长具有CD8+ T细胞反应的胰腺癌患者的存活率,但疫苗反应率不理想(40%患者无反应),并且在联合疗法中对延长患者的生存期也没有统计学的意义。但这给后面疫苗的研发带来了一些启示。
UV1
UV1疫苗是针对用GV1001处理后表位扩散事件产生的表位开发的,刺激广泛的CD4 +和CD8+ T细胞对hTERT 的反应。UV1目前处于II期临床试验(NCT04382664),FDA现已批准UV1与抗PD1疗法联合用于治疗晚期恶性黑色素瘤的快速通道批准。
Vx-001
Vx-001含有两种hTERT肽,在各种类型的癌症患者中显示出持久的免疫原性和生存期延长。大约30%的非小细胞肺癌患者中具有持久的免疫反应,这些反应者,包括那些预后不良的患者,其生存率明显长于无反应者(分别为21.3和13.4个月; P =0.004)。但鉴于反应率低,在比较接种疫苗和未接种疫苗的患者的总体队列时,没有观察到生存期延长。
INVAC1
INVAC1是一种基于DNA的疫苗,由编码融合到泛素的灭活形式的hTERT的质粒组成。当表达时,hTERT会被蛋白酶体降解,使其抗原呈递以刺激免疫反应。在小鼠肉瘤模型中,INVAC1刺激了广泛的hTERT特异性免疫反应,包括产生大量CD4+ TH 1效应细胞和记忆CD8+ T细胞,这导致存活率提高了50% 。
INVAC1的I期临床试验发现该疫苗耐受性良好,触发了hTERT特异性CD4+和CD8 + T细胞反应,并在58%的复发性或难治性实体瘤患者中阻止了癌症进展。INVAC1现在已进入II期临床试验(NCT03265717) 。
G4稳定配体
G4配体通过抑制端粒酶与端粒DNA结合的来抑制端粒酶的活性,与这一基本原理一致,POT1对端粒G4的展开对于正常的端粒酶持续合成能力和防止端粒酶停滞是必要的。
目前发现的G4稳定配体,包括端粒抑素、TMPyP4、RHPS4和pyridostatin。它们在抑制端粒酶结合和持续合成能力方面差异很大。
Telomestatin是一种天然存在的大环化合物通过诱导分子内反平行G4的形成和稳定来防止端粒酶延伸端粒。端粒抑制素治疗会损害端粒延伸,并与一系列癌细胞系和异种移植物的细胞毒性有关。
卟啉TMPyP4促进分子间G4的形成,对端粒酶活性具有有效的抑制作用,并且可以抑制体内肿瘤生长。
G4配体抑制端粒酶的主要风险之一是富含G的DNA普遍存在,并倾向于在整个基因组中形成G4,包括在癌基因的启动子区域。因此,G4配体可能会产生显著的脱靶效应。还表明,以平行构象存在的端粒G4结构的子集可以通过端粒酶延伸,尽管与线性DNA的亲和力较低,这表明端粒酶延伸与G4稳定剂的存在相容。
靶向ALT的癌症药物研发
ALT所涉及的通路对于正常的DNA复制和修复也是至关重要的,因此,针对ALT阳性癌症的大部分药物发现过程都集中在寻找可药用靶点。并且ALT激活是长期抗端粒酶治疗的耐药机制,因此端粒酶阳性肿瘤患者可能需要ALT靶向治疗癌症的复发。
临床前研究表明,在ALT阳性癌细胞中,PARP抑制剂会导致TRF2从端粒解离,从而刺激不适当的非同源末端连接修复。这导致了致命的端粒融合,最终导致小鼠ALT阳性颅内星形细胞瘤的细胞凋亡和生长受损。
染色质重塑途径
ALT阳性癌细胞表现出功能丧失的ATRX和/或DAXX突变,这表明这些癌症类型更容易受到HSV1(溶瘤单纯疱疹病毒1型)感染,HSV1可以选择性地感染、在癌细胞内复制并诱导癌细胞溶解。
复制压力调节剂
当DNA中的损伤阻碍复制叉的进展时,就会出现复制压力,导致叉停滞,而使用ALT的端粒复杂二级结构使复制变得困难。一般情况有复制应激反应蛋白SWI/SNF相关的基质相关肌动蛋白依赖性染色质亚家族A样蛋白1调节因子(SMARCAL1),连同范可尼贫血蛋白范可尼贫血互补组M(FANCM)和FANCD2等蛋白质重塑复制叉,触发叉回归和复制的重新启动,如果未修复,停滞的叉可能会恶化为DSB,最终促进DNA修复因子的募集和HDR机制的参与,从而延长端粒。
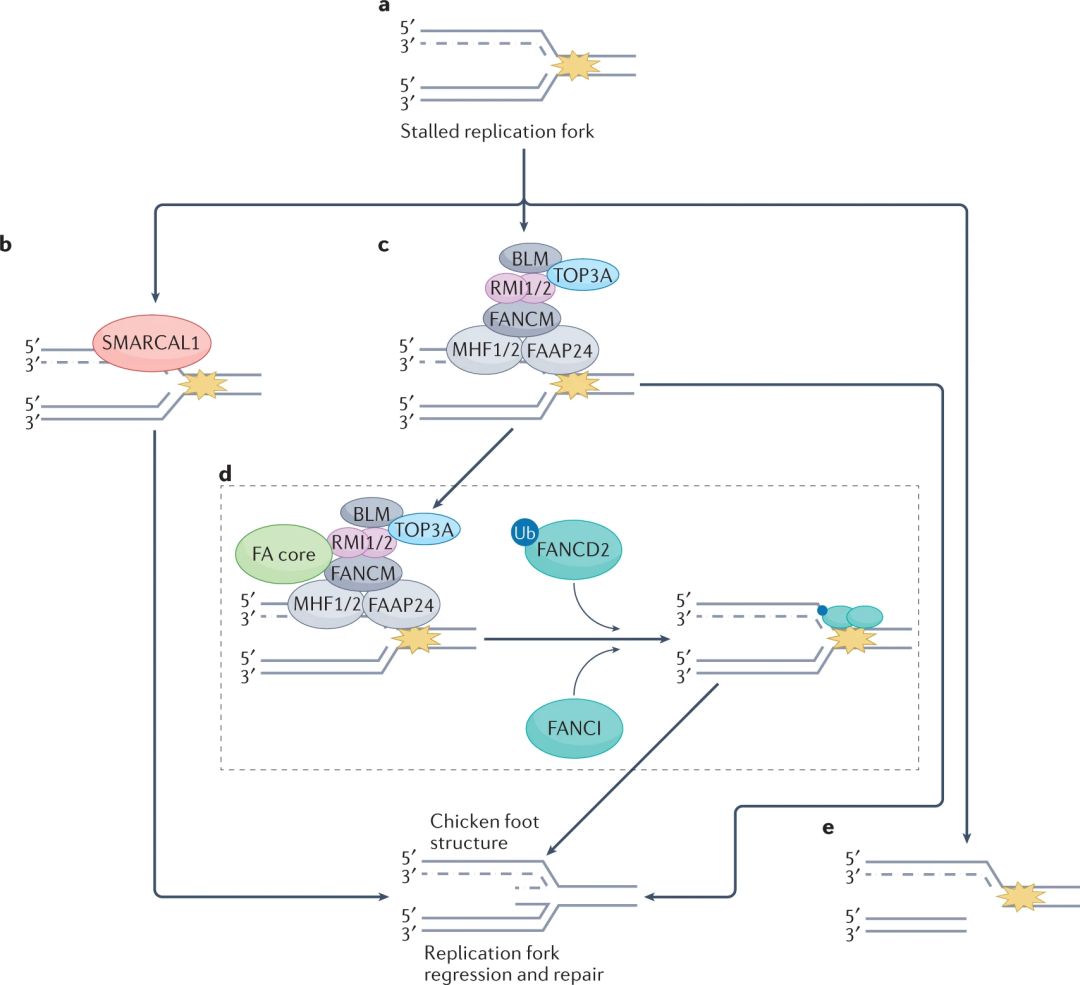
因此,用于癌症治疗的共济失调-毛细血管扩张症突变(ATM)和ATM和RAD3相关(ATR)蛋白激酶抑制剂也被用来治疗 ALT阳性癌症患者。AZD0156在ALT阳性神经母细胞瘤中显示出选择性毒性,目前处于I期临床试验( NCT02588105 )。
FANCM
FANCM是一种DNA转位酶,它使用ALT通过促进分支迁移来减弱端粒的复制压力,这会导致复制叉回归以及D环和R环的位移。FANCM耗竭导致细胞进入高ALT状态,其特征是端粒损伤增加和ECTRDNA的显著诱导,最终对使用ALT 的细胞产生毒性。
PIP-199是FANCM-BTR蛋白质-蛋白质相互作用的抑制剂,ALT阳性癌细胞系对小分子抑制剂PIP-199的敏感性增加。
潜在的新靶点
STING
环状GMP-AMP合酶(cGAS )-干扰素基因刺激物途径是先天免疫系统的一部分,它可以感知宿主和外来细胞溶质双链DNA以启动I型干扰素反应。癌症的情况下,干扰素反应导致细胞凋亡,从而提供关键的肿瘤抑制功能,使用ALT的细胞产生的ECTRDNA可以刺激这种干扰素反应。
破坏APB形成
方法包括靶向SUMO连接酶以破坏将PML组件结合在一起的SUMO-SIM相互作用(例如sumoylation),抑制PML蛋白和APBs形成的的2',3',4'-三羟基黄酮(2-D08,其也会造成SUMO从UBC9硫酯缀合物转移到SUMO底物抑制)。
也可以利用泛素连接酶对遮蔽蛋白成分进行邻近依赖性降解,比如关键蛋白 POT1,其是helterin复合体的成分之一,与APB内的泛素特异性加工蛋白酶7(USP7)去泛素酶共定位。没有POT1 shelterin复合体就会受损,导致端粒功能障碍和细胞死亡。
小结
虽然已开发的端粒酶抑制剂极具前景,包括极具吸引力的hTERT疫苗和imetelstat,它们获得了FDA的快速批准,但最近的研究集中在ALT阳性癌症患者领域。随着对ALT机制的日益了解,多年来发现的偶然靶向ALT途径成分的抑制剂因为其在ALT阳性患者中的效果正越来越受到认可。而ALT靶向疗法为治疗大部分肿瘤类型提供了广泛的精准方法,目前需要努力的方向是优化疗效和疗。